L’air du matin, saturé d’odeurs venues des champs, vous surprend-il parfois par cette senteur piquante, presque métallique, qui flotte au-dessus des épis de maïs ? L’esprit vagabonde, se perd dans ce parfum étrange. Un secret de la nature ou une énigme chimique ? Derrière cette brume fugace, se cache un invité invisible, à la fois discret et flamboyant, qu’on nomme acide nitreux. D’accord, le nom n’a rien de poétique, mais l’histoire, elle, s’écrit sur le fil de la volatilité et des couleurs. L’acide nitreux, ce n’est ni un simple acide, ni un banal gaz, mais un acteur qui choisit toujours le hors-scène, ne se laissant capturer que dans l’instant, avant de s’évanouir.
Que sait-on vraiment de cette molécule qui n’existe qu’en solution ou sous forme gazeuse, jamais docile, jamais stable ? Avez-vous déjà songé à la façon dont une seule molécule, aussi instable soit-elle, peut bouleverser le laboratoire, teinter les tissus et même jouer un rôle dans l’atmosphère ? Prêt à vous laisser surprendre par la chimie, là où elle ne s’annonce jamais ?
La molécule HNO2 et ses propriétés, une chimie qui hésite entre transparence et éclat
Le monde de l’acide nitreux, ou acide dioxonitrique(III), s’ouvre sur une simplicité qui trompe. Son nom savant ne vous impressionne pas ? Attendez de voir ce qu’il cache. Trois atomes, un hydrogène, un azote, deux oxygènes, s’unissent dans une géométrie subtile, cette forme de V qui, sur une feuille de Lewis, semble anodine. Pourtant, cette courbure dicte presque tout : la réactivité, la fragilité, la couleur. Certains diraient que la molécule ressemble à un boomerang miniature, d’autres verraient une aile repliée. Tout dépend du regard.
La structure de l’acide nitreux, ce n’est pas juste une question de chimie, mais une question d’équilibre. L’azote central, les oxygènes, l’hydrogène, chaque liaison compte. Avez-vous déjà tenté de tracer la structure de Lewis de ce composé ? Vous pourriez croire à un exercice scolaire, mais derrière ce schéma, tout le mystère reste entier. L’acidité, la réactivité, la décomposition, tout découle de ce dessin. Et la couleur ? Presque absente en apparence, mais prête à surgir dans les réactions. Les étudiants, eux, tapent « hno2 lewis » dans leur moteur de recherche, cherchant à percer ce dessin qui en dit long sans jamais tout révéler.
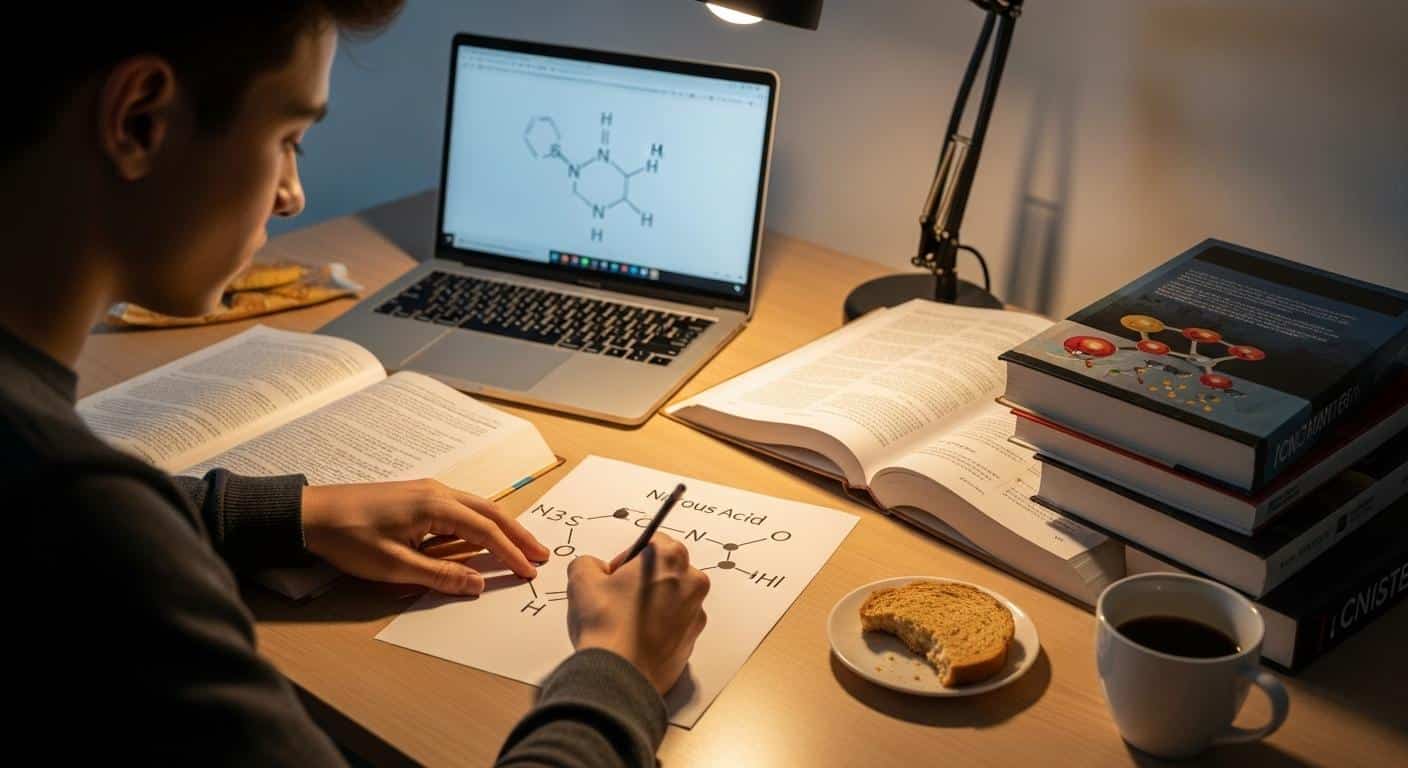
La formule brute, HNO2, intrigue par sa promesse d’instabilité. Contrairement à l’acide nitrique, son cousin plus célèbre et bien plus stable, le nitreux ne se laisse jamais isoler. L’acide nitreux n’existe qu’en solution aqueuse ou sous forme de gaz, jamais pur. Cette impossibilité de le stocker change la donne : il faut le fabriquer juste avant l’usage, dans la précipitation, dans la tension. Une molécule fragile, presque capricieuse, mais qui sait imposer ses conditions. En solution, elle ne laisse voir aucune couleur, mais dès qu’elle rentre en réaction, des nuances éclatantes apparaissent, notamment dans la fabrication des colorants azoïques qui habillent tissus et encres de mille reflets.
| Propriété | Valeur | Remarque |
|---|---|---|
| Formule chimique | HNO2 | Présence seulement en solution ou gaz |
| pKa | 3,3 | Caractère d’acide faible |
| Stabilité | Instable à température ambiante | Préparation nécessaire juste avant l’utilisation |
| État physique | Solution aqueuse ou gaz | Impossible à isoler pur |
L’instabilité, ce défaut selon certains, devient ici l’essence même du composé. Oubliez les fioles rangées sur les étagères du laboratoire, l’acide nitreux refuse d’attendre. Il s’échappe, se transforme, s’évapore, laissant à peine le temps de l’observer. Certains évoquent le nitrite d’hydrogène pour désigner cette entité fuyante, mais ce nom ne raconte qu’une partie de l’histoire. Sa fugacité, c’est le mouvement perpétuel de la chimie, cette danse moléculaire où rien ne demeure, où tout se transforme. Intrigué par cette molécule qui ne se fixe jamais ? Ce n’est qu’un début, car le vrai spectacle surgit lorsqu’elle entre en réaction et libère ses couleurs cachées.
La structure et la formule, une géométrie qui change tout ?
Pourquoi la forme en V de cette molécule détermine-t-elle tout ? L’acidité, la capacité à donner un proton, l’instabilité, tout découle de cette organisation des atomes. L’hydrogène attaché à l’oxygène, l’azote, ce chef d’orchestre central, et ces deux oxygènes qui balancent entre double et simple liaison. Ce n’est pas juste un dessin, c’est la carte d’identité d’un acide faible, prêt à se décomposer au moindre choc thermique. Les couleurs, elles, attendent dans l’ombre, prêtes à surgir dans la réaction suivante.
Le rôle de l’acide nitreux, entre laboratoire, pollution et lumière
Au laboratoire, l’acide nitreux joue les funambules, oscillant entre nécessité et danger. L’industrie des colorants azoïques doit sa palette à cette molécule instable. La réaction de diazotation, ce moment où une amine aromatique croise l’acide nitreux, donne naissance à des sels de diazonium qui, eux-mêmes, se transforment en pigments éclatants. Jaune, rouge, orange, toute la gamme y passe. Mais attention, tout doit se faire à basse température, sous peine de voir l’acide s’évaporer, d’un coup, sans prévenir.
L’acide nitreux, c’est la promesse d’une couleur vive, mais aussi le risque d’un échec rapide. Que de sueurs froides pour les techniciens ! L’industrie, elle, ne jure que par la précision : la température, la concentration, le temps, autant de variables à surveiller sans relâche. Les solutions de nitrite de sodium, précurseur direct du composé, se comptent en tonnes dans la fabrication mondiale de colorants. Mais la chimie du nitreux, ce n’est jamais une routine, toujours un équilibre sur le fil.
Claire, technicienne en chimie organique à Lyon, raconte : « Un matin, la couleur de la solution a viré au rose vif, le signe tant attendu que l’acide nitreux avait parfaitement réagi. Quelle satisfaction ! Mais il suffit d’une hésitation, la main qui tremble, et toute la réaction s’effondre. C’est grisant, et terrifiant à la fois. »
Les effets sur l’environnement, pollution, radical OH et ozone, qui tire les ficelles ?
En dehors du laboratoire, l’acide nitreux devient un acteur discret mais déterminant de la pollution atmosphérique. Les épisodes de smog, la formation d’ozone troposphérique, tout commence souvent par la libération du radical hydroxyle, ce fameux OH. Sous l’effet du soleil, l’acide nitreux se dissocie et relâche ce radical, qui attaque alors les polluants organiques, accélère leur décomposition, et finit par former de l’ozone. La belle histoire des couleurs prend ici une tournure moins réjouissante.
| Composé | Effet sur l’air | Source principale |
|---|---|---|
| Acide nitreux | Libération du radical OH, implication dans la pollution photochimique | Engrais azotés, réduction du dioxyde d’azote |
| Ozone | Irritation, formation de smog | Transformation secondaire de polluants organiques |
| Dioxyde d’azote | Formation d’acide nitreux, acidification de l’air | Transports, combustion de carburants fossiles |
La question « l’acide nitreux est-il un acide ou une base ? » revient souvent, mais la réponse reste floue, tant son comportement dépend du contexte. Les engrais, eux, participent activement à la production de ce composé dans l’air rural, multipliant les réactions en chaîne. Les concentrations augmentent avec la chaleur, accélérant la formation du radical OH et la dégradation des composés organiques volatils. L’été, l’air devient plus lourd, plus chargé, et l’acide nitreux orchestre, dans l’ombre, cette transformation invisible.
- Production de colorants azoïques
- Formation du radical OH dans l’atmosphère
- Transformation des polluants organiques
- Équilibre entre acidité et instabilité
Les méthodes de préparation et la stabilité, ou comment apprivoiser l’insaisissable
Qui n’a jamais vu ce ballet minutieux dans un laboratoire, où le nitrite de sodium s’ajoute à l’acide chlorhydrique, tandis que le thermomètre ne quitte pas des yeux la cuvette à 5 °C ? Préparer l’acide nitreux, c’est courir contre la montre, éviter la décomposition, surveiller la température à chaque seconde. Pas de distraction, pas de retard, sinon, tout s’effondre.
L’acide nitreux ne supporte pas l’attente : il se décompose, il s’évapore, il ne laisse aucune chance à l’improvisation. Les manuels de chimie le rappellent sans détour : « Préparez-le sur le moment et utilisez-le tout de suite ». Cette précarité explique pourquoi il n’existe pas de flacon d’acide nitreux pur, nulle part, même dans les plus grands laboratoires du monde.
La dismutation, ce drôle de sort qui guette la molécule
La vie de l’acide nitreux se résume à quelques instants. À température ambiante, il subit la dismutation, se transformant en monoxyde d’azote (NO) et ion nitrate (NO3–). Le diagramme de Frost, ce graphique fascinant de l’oxydation de l’azote, s’invite alors dans l’esprit de chaque chimiste. L’azote passe de l’état +III à +II et +V, une transition éclair, un saut quantique en miniature. Les nitrites, eux, restent plus stables, comme le nitrite de potassium, si souvent utilisé pour générer ce fameux acide en laboratoire. Le mot « nitrite de potassium formule » s’affiche souvent dans les recherches, preuve que la préparation passe toujours par des précurseurs plus dociles que le produit final.
Les anecdotes spatiales et l’évasion de l’acide nitreux, la chimie qui tutoie les étoiles
Le 9 juillet 2021, l’annonce fait sourire et secouer les têtes : l’acide nitreux a été détecté dans l’espace, au cœur de la composante B du système binaire IRAS 16293−2422. Les spécialistes restent perplexes : comment une molécule si instable, si capricieuse, résiste-t-elle au vide interstellaire ? Cette découverte bouleverse les certitudes, repousse les frontières de la chimie. L’acide nitreux, désormais, n’appartient plus seulement au laboratoire ou à l’atmosphère terrestre, mais rejoint la danse des molécules cosmiques, là où naissent les étoiles.
La chimie du nitreux ne s’arrête pas à la Terre. Elle raconte la naissance des mondes, la complexité qui précède la vie, l’inattendu qui surgit dans les nuages interstellaires. L’histoire de cette molécule, c’est celle d’une fugacité, d’un élan, d’une présence rare, qui sait marquer le monde, du tissu le plus éclatant aux brumes cosmiques.
Et si la prochaine surprise venait d’une réaction inattendue ou d’une observation astronomique ? L’acide nitreux, ce fugitif, n’a peut-être pas fini de colorer la science et l’imaginaire, au détour d’un champ, dans une éprouvette ou au cœur d’une nébuleuse.


