Un verre d’eau posé là, sur cette table, parfaitement translucide, attire rarement l’attention. Pourtant, sous cette surface immobile, une multitude d’échanges se produisent à l’échelle moléculaire. Avez-vous déjà songé aux milliards de molécules qui, à chaque seconde, s’échangent des protons ? Cette agitation, invisible à l’œil nu, s’appelle l’autoprotolyse de l’eau ou, pour varier, l’auto-ionisation de l’eau. Un phénomène rare, discret, presque poétique, à l’origine du pH et de l’équilibre délicat qui caractérise chaque solution aqueuse.
À chaque instant, l’eau façonne un équilibre chimique qui tient du miracle silencieux. Le pH, les réactions acido-basiques, la stabilité de la vie elle-même, tout dépend de cette harmonie fragile. L’eau n’est jamais vraiment « pure ». Elle s’auto-ionise, produit des ions, les annule, les recrée, dans une valse incessante. Vous avez déjà pensé à la subtilité de ce processus ? Ou bien le mot « autoprotolyse » vous paraissait-il réservé à d’obscurs cours de chimie ? Il est temps de voir ce liquide autrement. L’histoire se faufile là où, en apparence, rien ne bouge.
L’autoprotolyse de l’eau, un phénomène d’auto-ionisation discret, mais décisif
Qui s’attarde vraiment sur la chimie de l’eau, sauf les initiés ou les passionnés de science ? Pourtant, derrière sa neutralité apparente, l’eau orchestre une réaction intime et fondamentale.
La réaction chimique, les produits ioniques — que devient l’eau lors de la dissociation ?
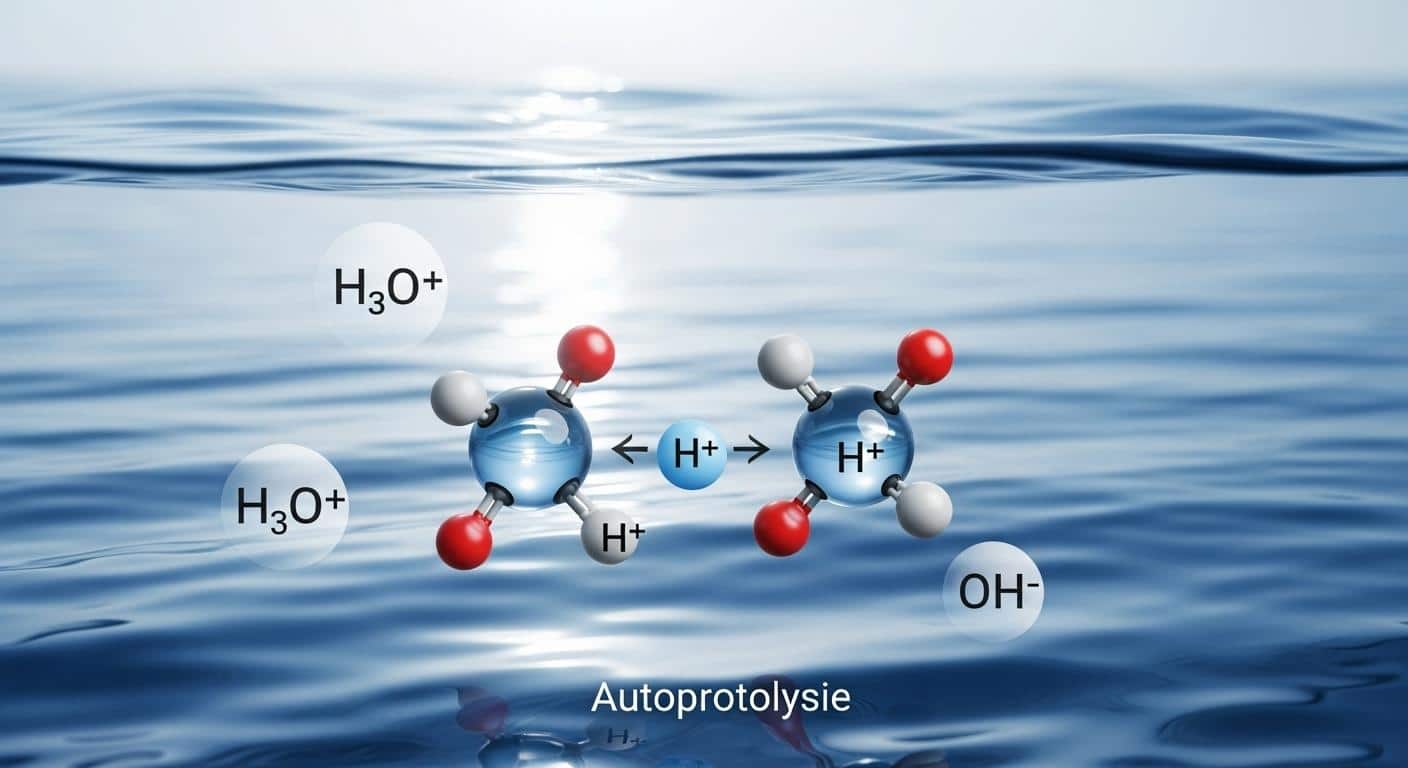
L’eau refuse d’être un simple figurant. Deux molécules d’H2O se croisent, un proton s’échange, et voilà nés deux nouveaux venus : l’ion oxonium (H3O+) et l’ion hydroxyde (OH–). L’équation qui résume tout ce ballet ? H2O + H2O ⇌ H3O+ + OH–. Un échange minuscule, moins d’une molécule sur dix millions franchit le pas. Pourtant, tout découle de là, absolument tout.
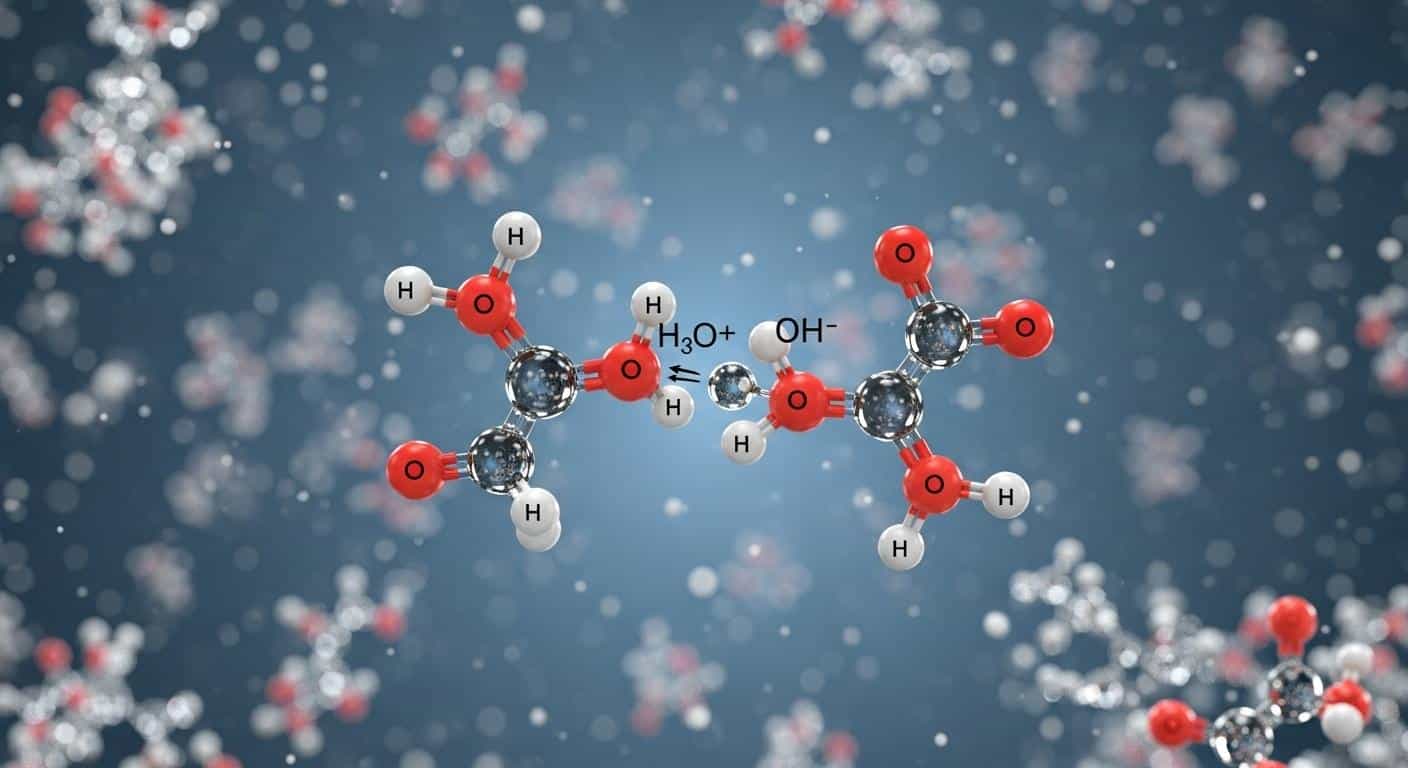
L’auto-ionisation de l’eau génère en continu les deux ions qui définissent l’acidité et la basicité. C’est fou, non ? Sans cette réaction, impossible de parler de solution neutre ni d’équilibre ionique. C’est cette dissociation, rare, qui donne au pH tout son sens. Pourquoi si peu de molécules d’eau franchissent le cap ? La stabilité de l’eau, tout simplement, freine la dissociation. Pourtant, sans cette exception, l’eau resterait un liquide insipide, incapable de tamponner quoi que ce soit. Voilà la révolution moléculaire qui se joue dans chaque goutte. Oui, rien n’est jamais vraiment immobile.
En 2025, les scientifiques confirment la même chose : la concentration des ions H3O+ et OH– dans l’eau pure à 25 °C atteint 10-7 mol/L. Minuscule, certes, mais suffisant pour influencer le vivant, l’industrie, l’agroalimentaire. Le goût de votre café du matin ? Il doit aussi à cette chimie silencieuse. L’eau, en produisant ce duo ionique, fait naître le pH. Difficile d’imaginer une solution sans ce mécanisme qui équilibre tout, sans jamais se montrer.
Le caractère amphotère, la théorie de Brønsted-Lowry et le double visage de l’eau
L’eau ne choisit jamais un camp. Elle joue sur les deux tableaux. La théorie de Brønsted-Lowry le dit bien : l’eau agit parfois en acide, parfois en base. Elle cède un proton dans une réaction, elle en accepte dans une autre. Prenez la réaction entre la méthylamine et l’eau : CH3NH2 + H2O ⇌ CH3NH3+ + OH–. Ici, l’eau se fait acide. Dans l’autre sens, avec HSO4– + H2O ⇌ SO42- + H3O+, elle devient base. Déroutant ? Oui, mais fascinant aussi.
L’eau s’impose en solvant universel des réactions acido-basiques. Ce statut, amphotère, explique pourquoi l’auto-ionisation de l’eau aboutit à la création simultanée des deux ions. Ingénieux, non ? Elle s’adapte, équilibre, régule. Rien d’étonnant à ce que la chimie moderne lui consacre tant de chapitres. Selon l’IUPAC, comprendre cette double identité reste fondamental pour toute l’analyse chimique. Sans ce visage à double facette, pas d’équilibre, pas d’auto-ionisation, pas de pH. Tout s’enchaîne, implacablement.
Le produit ionique de l’eau, la constante Ke, ce baromètre chimique
Un équilibre invisible, mais essentiel, régit l’eau. La constante Ke, ce produit ionique redouté des étudiants, orchestre tout. À 25 °C, Ke vaut 10-14. Mais l’équilibre n’est jamais figé. Un peu de chaleur, et Ke grimpe. Un froid glacial, et Ke chute. L’eau s’ajuste en silence, sans prévenir.
La valeur de Ke varie-t-elle vraiment selon la température ?
Ke, le produit ionique de l’eau, évolue avec la température. À 0 °C, Ke tombe à 10-15. À 40 °C, il grimpe à 2,9 × 10-14. Un changement de température dans votre laboratoire, et l’équilibre ionique vacille, recalculant toutes les concentrations. Même le pKe, défini comme -log(Ke), suit le mouvement, passant de 15 à 0 °C à 13,5 à 40 °C.
| Température (°C) | Ke | pKe |
|---|---|---|
| 0 | 1,0 × 10-15 | 15,0 |
| 25 | 1,0 × 10-14 | 14,0 |
| 40 | 2,9 × 10-14 | 13,5 |
Le produit ionique de l’eau agit comme un thermomètre invisible, ajustant l’équilibre en silence. Nulle solution n’échappe à cette règle, qu’elle soit acide, basique ou neutre. Qu’est-ce que cela implique pour vos mesures ? Une vigilance accrue, car chaque degré compte. Oui, même votre eau du robinet n’y échappe pas.
Le lien pH, pOH, Ke, une équation qui régit tout
Le pH, ce chiffre qui fait trembler les étudiants, obéit à une seule règle mathématique : pH + pOH = pKe. À 25 °C, la somme donne 14. À 0 °C, elle grimpe à 15. Pas un simple jeu de chiffres, mais la base de tous les calculs de concentrations ioniques.
Un exemple tout simple : une solution dont le pH vaut 10 contient H3O+ à 10-10 mol/L. Pour dénicher la concentration en OH–, il suffit de diviser Ke par 10-10, soit 10-4 mol/L. La vérification, elle, passe par le pOH : 14 – 10, soit 4. On obtient alors [OH–] = 10-4 mol/L. À chaque température, l’équilibre change, le pKe ajuste tout. La constante d’équilibre veille, guide, rectifie l’évaluation du pH, sans relâche.
Les solutions acides, basiques, neutres, où se situer grâce à l’auto-ionisation ?
L’auto-ionisation de l’eau trace des frontières invisibles entre acidité, basicité et neutralité. Tout se joue dans l’équilibre des ions H3O+ et OH–. Dans une solution neutre, à 25 °C, ces concentrations s’équilibrent à 10-7 mol/L. Un acide ? Le taux d’ions oxonium explose, celui d’hydroxyde s’effondre. Une base ? L’inverse se produit. Ce mouvement perpétuel définit la nature de la solution.
- Solution neutre : concentrations identiques en H3O+ et OH–
- Solution acide : plus d’ions oxonium que d’hydroxyde
- Solution basique : davantage d’ions hydroxyde que d’oxonium
- Le pH : inférieur à 7 pour un acide, supérieur à 7 pour une base (à 25 °C)
Cette classification n’a rien d’abstrait. La dissociation de l’eau sert de référence absolue pour catégoriser toute solution aqueuse. Le produit ionique guide les chimistes : pH de 7 à 25 °C, solution neutre. Moins de 7 ? L’acidité domine. Plus de 7 ? La basicité prend le dessus. Tout cela repose sur l’auto-ionisation… et sur cette oscillation moléculaire qui ne s’arrête jamais.
« J’avais toujours vu l’eau comme une substance banale », confie Julie, étudiante en pharmacie à Lyon. « Un jour, lors d’un TP, notre professeur a inversé le pH de l’eau simplement en la chauffant de quelques degrés. J’ai compris ce jour-là à quel point la dissociation de l’eau conditionne tout l’équilibre chimique. Depuis, je commence chaque dosage en vérifiant la température ! »
L’ajout d’acides, de bases, et ce que l’eau fait pour résister
Face à l’intrusion d’un acide ou d’une base, l’eau réagit. Pas une réaction explosive, mais un ajustement subtil, orchestré par la fameuse Loi de Le Chatelier.
La Loi de Le Chatelier, l’équilibre ionique, et la ténacité de l’eau
L’eau n’aime pas le désordre. Ajoutez un acide, la concentration d’ions oxonium grimpe, celle d’hydroxyde chute. Ajoutez une base, tout s’inverse. Pourtant, le produit [H3O+][OH–] renoue toujours avec Ke. La Loi de Le Chatelier orchestre la riposte. L’équilibre ionique s’ajuste, absorbe le choc, stabilise la solution. Ce mécanisme garantit la cohérence des réactions acido-basiques, leur prévisibilité rassurante.
La réversibilité de l’auto-ionisation offre à l’eau la possibilité de s’adapter en permanence. Cette flexibilité transforme l’eau en tampon naturel, assurant la stabilité chimique dans les milieux vivants ou industriels. Les chimistes, biologistes, et même les baristas, jouent sur ces équilibres pour ajuster goûts, couleurs, textures. La dissociation de l’eau, régulée par la Loi de Le Chatelier, façonne chaque solution à sa façon. Un chef-d’œuvre discret de régulation moléculaire.
La dissociation de l’eau, une contribution réelle ou négligeable ?
Dans la plupart des solutions, la dissociation de l’eau passe inaperçue. Sauf dans les cas extrêmes. Dès que la concentration d’acide ou de base descend sous 10-7 mol/L, la contribution de l’eau s’impose. Les solutions ultra-diluées sont piégeuses. Le calcul du pH ne peut plus ignorer l’auto-ionisation.
Les solutions très diluées, quand la dissociation de l’eau devient incontournable
Une solution d’acide chlorhydrique à 6,3 × 10-8 mol/L semble acide. Mais si l’on néglige la dissociation de l’eau, le pH calculé dépasse 7. Absurde ? Oui. En tenant compte de l’ionisation de l’eau, le pH s’ajuste à 6,87, fidèle reflet de la réalité chimique.
Les praticiens de la chimie analytique le savent, un oubli sur ce point fausse les résultats. La contribution de la dissociation de l’eau devient prépondérante dès que l’apport extérieur d’ions s’efface. L’auto-ionisation de l’eau veille, même quand tout semble inerte. Un détail qui change tout.
L’eau, inerte ? Jamais. Derrière son apparente neutralité, se cache une histoire d’équilibres et de tensions invisibles. La prochaine fois que vous mesurerez un pH, repensez à ce duel moléculaire permanent. L’équilibre ionique naturel, si discrètement orchestré, n’a pas fini de surprendre. Prêt à regarder votre carafe d’eau autrement ?